06.11.2012
Effiziente Zellen dank "Portier-Proteinen"
Ordnung ist das halbe Leben. Dies wissen auch die Zellen. Forscher der Universitäten Freiburg (CH), Heidelberg (D) und Osaka (J) fanden nun einen Mechanismus, der beim Transport von Proteinen in den Zellkern die Ordnung wahrt.
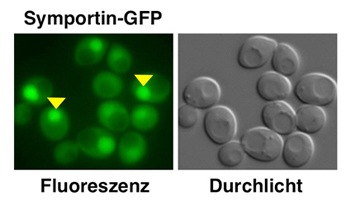
Subzelluläre Lokalisierung von Symportin-GFP in Zellen der Bierhefe. Links: Symportin ist sowohl im Zytoplasma als auch im Zellkern (gelbe Pfeilspitzen) anzutreffen (sichtbar dank Fluoreszenzmikroskopie). Rechts: Die gleichen Hefezellen in einem Durchlicht-Bild.
Sie stützen, bauen und transportieren: Im Innern von Zellen wuseln zehntausende von verschiedenen Proteinen herum, die an unterschiedlichsten Stellen spezifische Aufgaben zu erledigen haben. Eine der zentralsten Aufgaben dabei übernimmt das Ribosom, das den genetischen Code liest und entsprechende Proteine baut - eine Übersetzungsmaschine sozusagen zwischen Genen und Proteinen. Das Ribosom selbst beinhaltet wiederum etwa 80 verschiedene Protein-Bausteine. Die Zellen haben aber ein Problem: Nach der Herstellung der einzelnen Protein-Bausteine des Ribosoms müssen diese quasi zur Endmontage in den Zellkern transportiert werden. Da viele dieser Bausteine gleichzeitig und am gleichen Ort montiert werden müssen, vermutete man, dass es spezielle Proteine geben muss, die diesen Transport koordinieren – eine Art „Portiers“ am Eingangstor zum Zellkern, die für Ordnung sorgen. Dieter Kressler, Biochemiker an der Universität Freiburg (CH), hat nun zusammen mit Wissenschaftlern der Universitäten Heidelberg (D) und Osaka (J), tatsächlich ein solches Portier-Protein gefunden; die Studie der Forschenden wurde eben im Fachmagazin Science veröffentlicht.
Das Portier-Protein, das auf den Namen Symportin-1 getauft wurde, holt zwei unverzichtbare Bausteine des Ribosoms in der Zelle ab und sorgt dafür, dass diese beim Transport in den Zellkern immer schön ordentlich beieinander bleiben. Kressler und Kollegen fanden heraus, dass Zellen des Modellorganismus Saccharomyces cerevisiae (Bierhefe) ohne Symportin-1 kaum noch wachsen. Sie konnten den ganzen Transportweg des Protein-Trios in den Zellkern nachvollziehen. "Unsere Entdeckung ist das erste solide Beispiel für die Vermutung, dass gewisse Protein-Bausteine zusammen in den Zellkern importiert werden", erklärt Kressler.
Mutation verursacht Blutarmut
Ohne die von Symportin-1 transportierten Bausteine geht in der Zelle gar nichts mehr. Es gibt aber auch Mutationen in diesen Bausteinen, die beim Menschen zu Blutarmut führen (Diamond-Blackfan-Anämie). Dabei sterben die sich schnell teilenden Vorläuferzellen der Blutkörperchen aufgrund der leicht beschädigten Ribosomen häufiger ab.
Durch das Studium der Atomstruktur von Symportin-1 erkannten Kressler und Kollegen zudem, dass das Portier-Protein aussieht, wie wenn es aus zwei anderen Proteintypen zusammengesetzt wäre. Diese gut bekannten Portier-Proteine transportieren aber jeweils nur einen Baustein aufs Mal. Portier-Proteine sind nicht nur für den Transport zuständig, sondern schützen die Bausteine auch davor, wahllos an anderen Stellen eingebaut zu werden. Kressler vermutet nun noch mehr der ordnungsliebenden Sorte an Portiers in den Zellen: "Andere Proteine des Ribosoms haben ähnliche Probleme. Wir haben auch schon weitere Symportin-Kandidaten gefunden, die wir momentan intensiv untersuchen."
Link: Synchronizing Nuclear Import of Ribosomal Proteins with Ribosome Assembly, Science 2012, 338:666
Kontakt: Dr. Dieter Kressler, Departement für Biologie, Biochemie,
026 300 86 45, dieter.kressler@unifr.ch
http://www.unifr.ch/biochem/index.php?id=238
