06.11.2012
Des cellules plus efficaces grâce aux «protéines-portières»
L’ordre représente la moitié de la vie. Les cellules le savent bien. Des chercheurs des Universités de Fribourg (CH), Heidelberg (D) et Osaka (J) ont découvert un mécanisme qui garantit l’ordre durant le transport des protéines vers le noyau cellulaire.
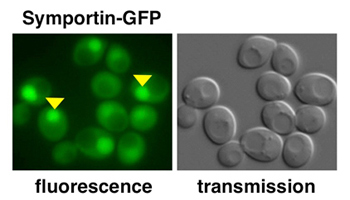
Localisation subcellulaire de la Symportin-GFP dans des cellules de levure de bière. A gauche: La Symportin se trouve dans le cytoplasme et dans le noyau (flèches jaunes). (visualisée grâce à la microscopie à fluorescence). A droite: les mêmes cellules dans une image lumineuse.
Au coeur des cellules, des milliers de protéines différentes, chargées d’accomplir une tâche spécifique dans des endroits les plus divers, s’agitent en tous sens: elles renforcent, construisent et transportent de toutes parts. Dans ce processus, le ribosome joue un rôle central puisqu’il lit le code génétique et construit les protéines en conséquence – un peu comme un traducteur gènes-protéines. Le ribosome lui-même contient environ 80 différentes protéines ribosomiques. Mais les cellules ont un problème: après la fabrication de chaque élément protéique du ribosome, celui-ci doit être acheminé dans le noyau cellulaire pour l’assemblage.
Comme un grand nombre de ces éléments protéiques doivent être assemblés au même endroit au même moment, on a supposé qu’il existait des protéines spéciales qui coordonnaient ce transport – comme des portiers qui veilleraient au maintien de l’ordre à l’entrée principale du noyau cellulaire. En collaboration avec des chercheurs des Universités d’Heidelberg (D) et d’Osaka (J), Dieter Kressler, biochimiste à l’Université de Fribourg (CH), a effectivement découvert une telle protéine-portière, comme le révèle une étude récemment publiée dans le magazine Science.
La protéine-portière, baptisée Symportin-1 récupère dans la cellule deux éléments protéiques indispensables du ribosome et veille à ce qu’ils restent côte à côte de façon ordonnée, durant l’acheminement dans le noyau cellulaire. Kressler et ses collègues ont constaté que, sans la Symportin-1, la croissance des cellules de l’organisme modèle Saccharomyces cerevisiae (levure de bière) est fortement ralentie. Ils ont également pu suivre le cheminement complet du transport du trio de protéines dans le noyau cellulaire. «Notre découverte est le premier exemple fiable qui nous laisse supposer que certaines protéines sont importées ensemble dans le noyau cellulaire», explique Kressler.
La mutation, source d’anémie
Sans les protéines transportées par la Symportin-1, rien ne va plus à l’intérieur de la cellule. Les mutations qui surviennent dans ces protéines provoqueraient même de l’anémie chez l’être humain (anémie de Diamond-Blackfan). Dans ce cas précis, les cellules souches des globules sanguins, qui se divisent rapidement, meurent à une plus grande fréquence à cause des ribosomes légèrement endommagés.
En étudiant la structure atomique de la Symportin-1, Kressler et ses collègues ont aussi découvert que la protéine-portière semble être composée de deux autres types de protéines. Pourtant celle-ci ne transporte qu’un seul module à la fois. Elle n’est pas seulement responsable du convoi, mais également de la protection des éléments protéiques pour qu’ils ne s’encastrent pas n’importe comment dans des endroits inadéquats. A ce jour, Kressler soupçonne l’existence de nombreuses autres variétés de protéines, gardiennes de l’ordre dans les cellules: «D’autres protéines du ribosome rencontrent des problèmes similaires. Nous avons déjà trouvé de nouvelles candidates au titre de Symportin, qui font en ce moment l’objet d’analyses intensives.»
Lien: Synchronizing Nuclear Import of Ribosomal Proteins with Ribosome Assembly, Science 2012, 338:666
Contact:
Dr Dieter Kressler, Département de biologie, biochimie, 026 300 86 45, dieter.kressler@unifr.ch
http://www.unifr.ch/biochem/index.php?id=238
